REACCIONES QUÍMICAS.
ESTEQUIOMETRÍA.
1. LEYES DE LAS REACCIONES QUÍMICAS.
Cuando se produce una reacción química, unas sustancias se transforman en otras. A las sustancias iniciales se las denomina reactivos y a las sustancias nuevas que se producen cuando ha transcurrido la reacción química se las denomina productos de la reacción.
A finales del siglo XVIII, la Química nació como ciencia gracias a los trabajos de Lavoisier.
 ⏩ Biografia de Lavoisier
⏩ Biografia de Lavoisier1.1. LEY DE CONSERVACIÓN DE LA MASA O LEY DE LAVOISIER. En cualquier reacción química, la masa de los reactivos que intervienen en la reacción ha de ser igual a la masa de los productos que aparecen en ella.
⏩Realiza las dos experiencias de la simulación. y comprueba que requisito es imprescindible para que se cumpla la ley de Lavoisier.
1.2. LEY DE LOS VOLÚMENES DE COMBINACIÓN O LEY DE GAY-LUSSAC. En reacciones entre gases y en la mismas condiciones de presión y temperatura, los volúmenes de los gases que reaccionan y los volúmenes de los productos gaseosos formados guardan entre sí una relación de números sencillos. Por ejemplo:
2 volúmenes de Hidrógeno + 1 volumen de Oxígeno  2 volúmenes de agua
2 volúmenes de agua
.EJERCICIO 1. Si hacemos reaccionar en un vaso de precipitados 130,8 g de cinc con 73,0 g de ácido clorhídrico, la masa final del sistema no es 203,8 g como cabe esperar sino 201,8g ¿Cuál puede ser la explicación?
SOLUCIÓN: |
2. MASAS ATÓMICAS Y MOLECULARES.
CONCEPTO DE MOL.
Los átomos y moléculas son entidades muy pequeñas por ello la IUPAC en 1961 adoptó como masa patrón o unidad de masa atómica, uma (u), a: “la doceaba parte de la masa del átomo del carbono 12."
La masa de una molécula es la suma de las masas de los diferentes átomos que la componen y que aparecen recogidos en la fórmula molecular correspondiente.
Así, la masa de una molécula de dióxido de carbono,CO2 es:
https://www.iesalandalus.com/joomla3/images/stories/FisicayQuimica/flash/fq3eso/ejercicios_moles_inicial.swf
https://www.iesalandalus.com/joomla3/images/stories/FisicayQuimica/flash/fq4eso/ejercicios_moles.swf
2.3. DETERMINACIÓN DE FÓRMULAS QUÍMICAS.
La fórmula química de un compuesto es la representación escrita de su composición mediante los símbolos químicos de los elementos que lo constituyen.
La fórmula de un compuesto puede ser:
* Empírica: indica cuales son los elementos que lo integran, y la proporción existente entre los átomos o los iones de dichos elementos. Es la forma más sencilla, pero sólo debemos utilizarla cuando no tengamos información suficiente.
* Molecular: señala la composición exacta, es decir, indica cuántos átomos de cada tipo de elemento forman la “unidad estructural” de dicho compuesto. La fórmula molecular es un múltiplo entero de la fórmula empírica. (Para determinar la fórmula molecular de un compuesto, es decir, el número real de átomos que lo constituyen, debemos además conocer o calcular su masa molecular).

2.4. COMPOSICIÓN CENTESIMAL. FÓRMULA EMPÍRICA.
Si tomamos en consideración la masa de los átomos, la fórmula de una combinación química expresa además la proporción en masa en la que los elementos intervienen en ella.
3. LA MATERIA CON LA QUE TRABAJAMOS.
Es la forma más frecuente de expresar la concentración. Indica la cantidad de soluto, expresada en moles, contenida en un volumen de disolución, expresado en litros.
3.2. LOS GASES.
3.2.5. MEZCLA DE GASES.
La presión de vapor depende del tipo de sustancia y de la temperatura a la que medimos dicha presión; generalmente, cuanto mayor es la temperatura, mayor es la presión de vapor, ya que aumenta el proceso de evaporación.
Especial interés tiene conocer la presión de vapor del agua, ya que en numerosos procesos tanto en el laboratorio como en la industria, es habitual recoger gases sobre agua. En estos casos, de acuerdo con la ley de la presiones parciales, la presión total es la suma de la presión del gas más la presión de vapor:
Para cualquier sustancia líquida existe una temperatura a la cual su presión de vapor se iguala con la presión atmosférica; esta temperatura es lo que conocemos como punto de ebullición.
CONCEPTO DE MOL.
Los átomos y moléculas son entidades muy pequeñas por ello la IUPAC en 1961 adoptó como masa patrón o unidad de masa atómica, uma (u), a: “la doceaba parte de la masa del átomo del carbono 12."
La masa de una molécula es la suma de las masas de los diferentes átomos que la componen y que aparecen recogidos en la fórmula molecular correspondiente.
Así, la masa de una molécula de dióxido de carbono,CO2 es:
1 (m C) + 2 (m O) = 1 · 12,011 u + 2 · 16,000 u = 44,011 u
⏩ VER EXPERIMENTO. Masas atómicas y moleculares.
2.1. MOL Y NÚMERO DE AVOGADRO.
En cualquier muestra química existe un número enorme de átomos y moléculas, conviene fijar una unidad que represente un gran número de ellas.
Así surge el concepto de mol, que la IUPAC define como: “la cantidad de sustancia que contiene tantas entidades elementales como átomos hay en 0,012 kg del isótopo de carbono 12".
El número de entidades elementales que hay en un mol se denomina número o constante de Avogadro, NA. En la actualidad, el valor establecido experimentalmente para el número de Avogadro es de 6,02221667·10^23 entidades/mol.
❐ La masa de un mol de átomos coincide con su masa atómica, expresada en gramos.
❐ La masa de un mol de moléculas coincide con su masa molecular, expresada en gramos.
Así, para el hidrógeno su masa atómica es 1,008 u, y la masa de un mol de átomos de hidrógeno es 1,008 g.
Mientras que para el agua, su masa molecular es 18,016 u, y la masa de un mol de moléculas de agua es 18,016 g.
https://labovirtual.blogspot.com/search/label/El%20mol
2.2. VOLUMEN MOLAR.
El volumen que ocupa un mol de cualquier sustancia se denomina volumen molar; sin embargo, éste varía mucho, según se trate de un sólido, un líquido o un gas.
Por ejemplo, 1 mol de agua tiene una masa de 18,016 g en cualquiera de los tres estados y contiene NA moléculas, mientras que el volumen que ocupa en:
❐ Estado sólido es de 19,647 ml (la densidad del hielo a 0ºC es de 0,917 g/ml).
❐ Estado líquido es de 18,069 ml (la densidad del agua a 25ºC es de 0,99707 g/ml).
❐ Estado gaseoso depende de las condiciones de presión y temperatura. Experimentalmente, un mol de cualquier gas en condiciones normales (1 atmósfera de presión y 0 ºC de temperatura), ocupa un volumen aproximado de 22,4 litros.
El número de entidades elementales que hay en un mol se denomina número o constante de Avogadro, NA. En la actualidad, el valor establecido experimentalmente para el número de Avogadro es de 6,02221667·10^23 entidades/mol.
❐ La masa de un mol de átomos coincide con su masa atómica, expresada en gramos.
❐ La masa de un mol de moléculas coincide con su masa molecular, expresada en gramos.
Así, para el hidrógeno su masa atómica es 1,008 u, y la masa de un mol de átomos de hidrógeno es 1,008 g.
Mientras que para el agua, su masa molecular es 18,016 u, y la masa de un mol de moléculas de agua es 18,016 g.
https://labovirtual.blogspot.com/search/label/El%20mol
2.2. VOLUMEN MOLAR.
El volumen que ocupa un mol de cualquier sustancia se denomina volumen molar; sin embargo, éste varía mucho, según se trate de un sólido, un líquido o un gas.
Por ejemplo, 1 mol de agua tiene una masa de 18,016 g en cualquiera de los tres estados y contiene NA moléculas, mientras que el volumen que ocupa en:
❐ Estado sólido es de 19,647 ml (la densidad del hielo a 0ºC es de 0,917 g/ml).
❐ Estado líquido es de 18,069 ml (la densidad del agua a 25ºC es de 0,99707 g/ml).
❐ Estado gaseoso depende de las condiciones de presión y temperatura. Experimentalmente, un mol de cualquier gas en condiciones normales (1 atmósfera de presión y 0 ºC de temperatura), ocupa un volumen aproximado de 22,4 litros.
EJERCICIO 2. Calcula en 100 g de magnesio el número de moles y el número de átomos de magnesio.
SOLUCIÓN: EJERCICIO 3. En 176 gramos de dióxido de carbono, CO2. Calcula:
a) el número de moléculas de dióxido de carbono.
b) el número de átomos que hay en total.
EJERCICIO 8. Considera 2 litros de aire seco y 2 litros de aire húmedo (contiene vapor de agua), ambos en las mismas condiciones de presión y temperatura. Contesta: a) ¿en qué caso hay mayor número de moléculas?; b) ¿en qué caso hay mayor masa? Dato: el aire es una mezcla de oxígeno molecular y nitrógeno molecularc) el número de átomos de oxígeno. SOLUCIÓN: EJERCICIO 4. Para la acetona C3H6O. Determinar:
a) Cuántos átomos de hidrógeno (H) hay en una molécula de acetona.
b) Cuántos átomos hay en una molécula de acetona.
c) Cuántos átomos de hidrógeno (H) hay en un mol de acetona.
EJERCICIO5. Calcule cuántos gramos de cobre (Cu) hay en 7,33 ∙ 1023 átomos de este elemento.
SOLUCIÓN:
EJERCICIO 6. Determinar el volumen que ocupan, en C.N, 88 g de CO2.
SOLUCIÓN: EJERCICIO 7. Determinar el volumen que ocupan, en C.N, 5,62 . 1026 moléculas de CO2. EJERCICIO 9. Si la masa molecular del nitrógeno es 28 y la del oxígeno 32, contesta: a) ¿Qué ocupa más volumen, un mol de nitrógeno o un mol de oxígeno, ambos medidos en las mismas condiciones de presión y de temperatura?; b) ¿Qué contiene más masa, un mol de nitrógeno o uno de oxígeno?; c) ¿Dónde hay más moléculas, en un mol de nitrógeno o en uno de oxígeno? SOLUCIÓN 8,9. |
https://www.iesalandalus.com/joomla3/images/stories/FisicayQuimica/flash/fq3eso/ejercicios_moles_inicial.swf
https://www.iesalandalus.com/joomla3/images/stories/FisicayQuimica/flash/fq4eso/ejercicios_moles.swf
2.3. DETERMINACIÓN DE FÓRMULAS QUÍMICAS.
La fórmula química de un compuesto es la representación escrita de su composición mediante los símbolos químicos de los elementos que lo constituyen.
La fórmula de un compuesto puede ser:
* Empírica: indica cuales son los elementos que lo integran, y la proporción existente entre los átomos o los iones de dichos elementos. Es la forma más sencilla, pero sólo debemos utilizarla cuando no tengamos información suficiente.
* Molecular: señala la composición exacta, es decir, indica cuántos átomos de cada tipo de elemento forman la “unidad estructural” de dicho compuesto. La fórmula molecular es un múltiplo entero de la fórmula empírica. (Para determinar la fórmula molecular de un compuesto, es decir, el número real de átomos que lo constituyen, debemos además conocer o calcular su masa molecular).
EJEMPLO 1. El análisis químico de un compuesto orgánico gaseoso muestra que contiene un 85,63 % de C y un 14,37 % de H. ¿Cuál será la fórmula empírica de este compuesto? Si su densidad medida experimentalmente en condiciones normales es de 1,875 g/l ¿ Cuál será su fórmula molecular?
Si consideramos una muestra de 100 g de compuesto, de acuerdo con su composición, 85,63 g son de C y 14,37 g de H.
Si la fórmula de un compuesto indica la relación del número de átomos de cada elemento en una molécula, ¿Cuántos átomos de cada elemento hay en la muestra?
Puesto que la masa atómica del carbono es 12 g / mol, en 85,63 g hay:
85,63 g C ⋅ (1 mol átomos C / 12 g C) = 7,13 moles de átomos de C
De la misma forma, si el hidrógeno tiene una masa atómica de 1 g / mol en 14,37 g hay:
14,37 g H ⋅ (1 mol átomos H / 1 g H) = 14,37 moles de átomos de H
Para buscar la relación entre átomos, dividimos todas las cantidades entre la menor de ellas:
14,37 moles de átomos de H / 7,13 moles de átomos de H = 2,02
Obtenemos que el carbono y el hidrógeno se combinan en la relación de 1 mol de átomos de carbono a 2 moles de átomos de hidrógeno.
La verdadera fórmula del compuesto es un múltiplo entero de la formula empírica. Si la densidad medida en condiciones normales es de 1,875 g / L, la masa molecular del compuesto es:
1,875 g/L⋅ (22,4 L / 1 mol) = 42 g /mol
Luego la fórmula molecular del compuesto orgánico es: C3H6 |

2.4. COMPOSICIÓN CENTESIMAL. FÓRMULA EMPÍRICA.
Si tomamos en consideración la masa de los átomos, la fórmula de una combinación química expresa además la proporción en masa en la que los elementos intervienen en ella.
EJEMPLO 2. Así, la fórmula de la molécula de amoníaco, NH3, indica que contiene un átomo de nitrógeno y tres de hidrógeno. Como el átomo de H tiene una masa de 1,008 u y el átomo de N de 14,007 u es evidente que en una molécula de amoniaco hay:
(3,024 u de H / 17,031 u de NH3) ⋅ 100 = 17,76 % de hidrógeno
(14,007 u de N / 17,031 u de NH3) ⋅ 100 = 82,24% de nitrógeno.
|
.EJERCICIO 10. Si consideramos los compuestos benceno (C6H6) y acetileno (C2H2), ¿cuáles de las siguientes afirmaciones son ciertas: a) los dos tienen la misma fórmula empírica; b) los dos tienen la misma fórmula molecular; c) los dos tienen la misma composición centesimal.
SOLUCIÓN: EJERCICIO 11. La nicotina, una sustancia tóxica, tiene la siguiente composición centesimal C = 74,02%, H = 8,7% y N = 17,28% y una masa molecular de 162,20 g/mol. ¿Cuál es la fórmula empírica de la nicotina? ¿Y la molecular? SOLUCIÓN: EJERCICIO 12. Halla la composición centesimal del C2H2. SOLUCIÓN: |
3. LA MATERIA CON LA QUE TRABAJAMOS.
La
materia que nos rodea presenta diferentes formas y propiedades, pero
¿qué
tipos de sustancias nos encontramos más frecuentemente en el
laboratorio?
3.1. DISOLUCIONES.
En
la naturaleza, la materia rara vez se manifiesta en forma de
sustancias puras; en la mayoría de los casos, lo hace en forma de
mezclas. Así, el agua que bebemos, el aire que respiramos, o los
fluidos de nuestro cuerpo son disoluciones, pero, ¿qué
es en realidad una disolución?
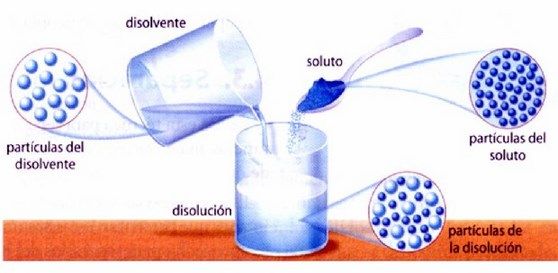
“Una
disolución es una mezcla homogénea de varios componentes, dos como
mínimo, en iguales o distintos estados de agregación, y que pueden
estar en cualquier proporción”.
En una disolución que está formada por varios componentes, uno de
ello es el disolvente
y los
demás son los solutos.

Las
disoluciones más habituales son las formadas por dos componentes. En
ellas:
El disolvente es el que da el estado
físico a la disolución. Si el soluto y el disolvente se encuentran
en el mismo estado, el disolvente es el que está en mayor
proporción. En
las disoluciones en agua (disoluciones acuosas), las más comunes en
química, el agua siempre es el disolvente.
El componente que está en menor
proporción o es distinto del agua, es el soluto.
Las
propiedades de una disolución varían, dependiendo de la naturaleza
y de las cantidades de soluto y disolvente presentes en ella.
También
podemos clasificar las disoluciones según la relación entre la
cantidad de soluto y la cantidad de disolvente en los siguientes
tipos:
Diluidas: si la cantidad de soluto
disuelta es muy pequeña comparada con la de disolvente.
Concentradas: cuando la cantidad de
soluto es apreciable en comparación con la de disolvente.
Saturadas: cuando el disolvente no
admite más cantidad de soluto..
Para
expresar cuantitativamente la cantidad de soluto disuelta en una
cantidad dada de disolución o de disolvente, recurrimos a la llamada
concentración, que podemos indicar de varias formas:
1.
- Concentración en tanto por ciento en masa o en volumen
(%)
El
tanto por ciento en masa indica la cantidad de soluto, expresada en
gramos, que hay disuelta en 100 g de disolución. Así,
si tenemos una disolución acuosa de ácido sulfúrico del 96% en
masa, significa que por cada 100g de disolución hay 96 g de ácido
sulfúrico.
%
(masa) = (masa de soluto / masa de disolución)
100
De
igual forma, el tanto por ciento en volumen indica la cantidad de
soluto expresada en litros que hay en 100 L de disolución. Esta
expresión se utiliza mucho cuando trabajamos con gases, por ejemplo,
si el aire tiene un 21% de oxígeno, significa que por cada 100
litros de aire hay 21 litros de oxígeno.
%
(volumen) = (volumen soluto / volumen disolución)
100
2.
- Gramos
por litro (g / L):
Indica
la masa de soluto, expresada en gramos, contenida en un litro de
disolución. Así,
una disolución de cloruro de sodio con una concentración de 40 g/l
contiene 40 g de cloruro de sodio en un litro de disolución.
g
/ L = nº de gramos de soluto / volumen de la disolución en litros
3.-
La molaridad (M):
Es la forma más frecuente de expresar la concentración. Indica la cantidad de soluto, expresada en moles, contenida en un volumen de disolución, expresado en litros.
4.
La molalidad (m):
Indica
la cantidad de soluto, expresada en moles, contenida en un kilogramo
de disolvente.
m
= nº moles de soluto / masa del disolvente en Kg
5.
- La fracción molar de soluto (χs)
o de disolvente (χd):
Expresa
la relación que hay entre el número de moles de un componente y el
numero de moles de todos los componentes presentes en la disolución.
Es una cantidad adimensional.
Xs = nº moles de soluto / nº moles de disolución
EJEMPLO 3. Disolvemos 180 g de sosa cáustica (hidróxido de sodio) en 400 g de agua. La densidad de la disolución resultante a 20ºC es de 1,340 g/ml. Calcula:
a) La concentración de esta disolución en tanto por ciento en masa; b) La concentración de la disolución en gramos por litro; c) La molaridad; d) La molalidad. SOLUCIÓN: EJEMPLO 4. a) ¿Qué volumen de ácido clorhídrico del 36% en masa y d = 1,17 g / mL necesitamos para preparar 50 mL de disolución del 12% en masa y densidad 1,05 g/ mL? |
EJERCICIO 13 . Una disolución de alcohol en agua es al 10% en volumen. ¿qué significa ésto?
EJERCICIO 14 . Calcula la concentración, en % en masa, de una disolución formada por 20 g de soluto y 180 g de disolvente.
EJERCICIO 15. Se prepara una disolución con 5 g de hidróxido de sodio en 25 g de agua destilada.
Si el volumen final es de 27,1 ml, calcula la concentración de la disolución en:
a) Porcentaje en masa b) gramos por litro c) Molaridad. SOLUCIÓN: SOLUCIÓN: EJERCICIO 16. Disponemos de 25 cc de HNO3, 16 M. Si se diluyen hasta que ocupen 0,4 litros, ¿qué molaridad tendrá la nueva disolución? SOLUCIÓN: EJERCICIO 17. Una disolución acuosa de hidróxido de sodio al 20 % en masa tiene una densidad de 1,25 g/cc. Halla: a) La masa de la disolución que contiene 36 g de hidróxido de sodio. b) El volumen de disolución que debemos tomar si necesitamos 40 g de NaOH. c) La masa de hidróxido de sodio contenida en 300 g de disolución. d) La masa de hidróxido de sodio que hay disuelta en 200 ml de disolución. SOLUCIÓN: |
3.2. LOS GASES.
Las
leyes de los gases se descubrieron en el siglo XVIII, cuando varios
científicos estudiaron como se comportaban los gases contenidos en
un recipiente, analizando su presión, su volumen y su temperatura.
El
estudio de los gases ideales ha tenido una importancia capital en el
desarrollo de la física y la química. La importancia que tienen en
el estudio del comportamiento de la materia se debe a que sus
moléculas están muy lejos unas de otras, esto hace que los gases
muestren un comportamiento uniforme y más simple que el de otros
estados de agregación.
3.2.4.
LEY DE LOS GASES IDEALES.
Las
leyes de los gases estudiadas: ley de Boyle, ley de Charles-Gay
Lussac, y ley de Avogadro, se agrupan en la llamada ecuación de
estado de los gases ideales:
P · V = n · R · T
Donde
n es el número de moles del gas considerado, P la presión
expresada en atmósferas, V el volumen en litros, T la temperatura
absoluta y R una constante, constante de los gases, cuyo valor es
0,082 atm L/mol K.
3.2.5. MEZCLA DE GASES.
Si
en un recipiente tenemos varios gases que no reaccionan químicamente
entre sí, la presión desarrollada por la mezcla contra las paredes
del recipiente viene dada por la ley enunciada por Dalton en 1801:
“La
presión total de una mezcla gaseosa es igual a la suma de las
presiones ejercidas por cada uno de los gases que forman parte de la
mezcla, considerados independientemente de los demás”;
es decir, cada uno de los gases se comporta como si estuviera solo
en el recipiente que los contiene.
3.2.6.
PRESIÓN DE VAPOR.
Un
líquido más o menos volátil, en contacto con el aire, desaparece
más o menos rápidamente, puesto que pasa a la atmósfera en estado
de vapor. Si
el líquido se coloca en un recipiente cerrado sin llenarlo
completamente, existe una tendencia por parte de las moléculas que
están en estado líquido a pasar al estado gaseoso y además, las
moléculas gaseosas que se acumulan en el espacio libre por encima
del líquido también se condensan. En el equilibrio, la velocidad
de ambos procesos se iguala. Las moléculas gaseosas formadas
ejercen una presión sobre el líquido, que denominamos presión de
vapor.
La presión de vapor depende del tipo de sustancia y de la temperatura a la que medimos dicha presión; generalmente, cuanto mayor es la temperatura, mayor es la presión de vapor, ya que aumenta el proceso de evaporación.
Especial interés tiene conocer la presión de vapor del agua, ya que en numerosos procesos tanto en el laboratorio como en la industria, es habitual recoger gases sobre agua. En estos casos, de acuerdo con la ley de la presiones parciales, la presión total es la suma de la presión del gas más la presión de vapor:
Presión
total = Presión del gas + Presión de vapor del agua.
Tabla
de presión de vapor del agua a diferentes temperaturas.
Temperatura
(ºC)
|
Presión
(mm Hg)
|
Temperatura
(ºC)
|
Presión
(mm Hg)
|
10
|
2,149
|
30
|
31,824
|
5
|
3,163
|
40
|
55,324
|
0
|
4,579
|
70
|
233,7
|
10
|
9,209
|
80
|
355,1
|
20
|
17,535
|
100
|
760
|
25
|
23,756
|
120
|
1489,14
|
Para cualquier sustancia líquida existe una temperatura a la cual su presión de vapor se iguala con la presión atmosférica; esta temperatura es lo que conocemos como punto de ebullición.
4. ECUACIONES QUÍMICAS.
Una ecuación química es la representación simbólica de una reacción química donde aparecen todas las sustancias que intervienen en ella, diferenciando los reactivos de los productos y mostrando las relaciones ponderales en que reaccionan y se forman, respectivamente.
⏩ REACTIVOS Y PRODUCTOS
4.1. INTERPRETACIÓN ATÓMICA.
Cuando una sustancia se transforma en otra u otras con diferentes propiedades, podemos pensar, de acuerdo con la teoría atómica de la materia, que ha habido una ruptura de enlaces y una formación de nuevos enlaces, es decir, un reagrupamiento de los átomos para dar nuevas moléculas. Esta modificación, que tiene lugar en el ámbito molecular, es la responsable de los cambios materiales observables a simple vista en las reacciones químicas.
⏩ Reaccion de síntesis: ruptura y formación de enlaces.
⏩ Reaccion de descomposición.
4..2. AJUSTE DE LAS ECUACIONES QUÍMICAS.
De acuerdo con la ley de conservación de la masa, una ecuación química sólo estará bien expresada sí:
a) Las sustancias están bien formuladas.
b) La ecuación está ajustada, es decir, el nº de átomos de cada elemento es el mismo en ambos miembros de la ecuación
Ajustar una ecuación química es asignar a cada compuesto (fórmula) un coeficiente para conseguir que en en cada miembro de la ecuación haya el mismo número de átomos de cada elemento. Por facilidad y rapidez, determinaremos los coeficientes por tanteo.
⏩ Observa: al ajustar, se iguala la masa y el número de átomos
.EJERCICIO 18 Ajusta las siguientes ecuaciones químicas:
a) H2 + O2 → H2 O b) Cl2 + H2 → H Cl
c) Cl2 + Na → Na Cl d) N2 + H2 → NH3
e) N2 + O2 → N2 O3 f) Zn + HCl → Zn Cl2 + H2
|
⏩Ajusta reacciones químicas II. Practica.
⏩ AUTOEVALUACIÓN.
______________________________________________________________________________
5. CÁLCULOS ESTEQUIOMÉTRICOS.
Cuando
queremos conseguir un determinado producto por medio de una reacción
química, necesitamos saber que cantidad queremos obtener y que
cantidades de reactivos precisamos para ello. Una ecuación química
ajustada proporciona información suficiente para poder llevar a cabo
estos cálculos, puesto que indica el número exacto de moles de las
sustancias que participan en la transformación química.
La ecuación química ajustada nos indica que:
⏩Información que nos da una ecuación química ajustada
Esquema a seguir en la resolución de problemas:
La ecuación química ajustada nos indica que:
2 H2 (s) + O2 (g) ⟹ 2 H2O (g)
2 moléculas de H2 reacciona con 1 molécula O2 para dar 2 moléculas de H2O
2 x 6,02·10^23 moléculas de H2 6,02·10^23 moléculas de O2 2 x 6,02·10^23 moléculas de H2O
2 mol de H2 reacciona con 1 mol de O2 para dar 2 mol de H2O
4 gramos de H2 reacciona con 32 gramos de O2 para dar 256 gramos de H2O
22,4 litros de H2 reacciona con 22,4 litros de O2 para dar 44,8 litros de H2O
⏩Información que nos da una ecuación química ajustada
Esquema a seguir en la resolución de problemas:

EJERCICIO 19. La aluminotermia es un proceso en el que se obtiene un metal a partir de su óxido al hacerlo reaccionar con aluminio. Calcula la masa de aluminio necesaria para transformar, totalmente, en hierro 150 g de óxido de hierro(III). La ecuación del proceso es:
Fe2O3 + 2 Al → 2 Fe + Al2O3. SOLUCIÓN: |
EJERCICIO 20. El cloro empleado en la purificación del agua se obtiene por descomposición electrolítica del agua de mar, según la ecuación 2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Calcula la masa necesaria de NaCl para obtener 250 L de Cl2, medidos en condiciones normales. SOLUCIÓN: |
EJERCICIO 21. Determina el volumen de una disolución de ácido clorhídrico de concentración 0,1 M que reacciona con 24 g de Zn. Según la ecuación: Zn + 2 H Cl → ZnCl 2+ H2
SOLUCIÓN: |
RENDIMIENTO. La cantidad máxima de un producto que podemos obtener a partir de
unas cantidades concretas de reactivos mediante cálculos
estequiométricos, se denomina rendimiento teórico. En numerosas
ocasiones, la cantidad obtenida en la práctica no coincide con la
calculada teóricamente. La eficacia de un determinado proceso viene
dada por el rendimiento real, que se expresa generalmente en tanto
por ciento:
%
rendimiento real = (cantidad real obtenida /cantidad teórica
calculada)
EJEMPLO 5. La fermentación de la glucosa para producir etanol tiene lugar de acuerdo con la ecuación: C6H12O6 → 2 C2H5OH + 2 CO2. Suponiendo que el rendimiento de la reacción es de un 30%, halla:
A) la masa de etanol que se producirá a partir de 210 g de glucosa. B) la masa de glucosa necesaria para obtener 150 g de etanol.
B)
|
EJERCICIO 22. El monoxido de nitrógeno reacciona con oxigeno para producir dióxido de nitrógeno.
a) Escribe la reacción y ajustala b) Calcula los moles de reactivos necesarios para producir 80 gramos de dióxido de nitrógeno. c) ¿Qué cantidad de dióxido de nitrógeno se forma a partir de 50 g de monóxido de nitrógeno si el rendimiento de la reaccio ́n es de un 80 %? SOLUCIÓN: |
REACTIVOS IMPUROS. Frecuentemente, las sustancias que intervienen en una reacción
química no son puras, sino que van acompañadas de otras, llamadas
impurezas,
que no intervienen en el proceso. Es por tanto necesario tener en
cuenta la pureza de los reactivos a la hora de realizar los
cálculos.
EJEMPLO 6. El Hierro y el cromo que se utilizan en la fabricación de acero cromado se obtienen mendicante el siguiente proceso FeCr2O4 + 4 C → Fe + 2 Cr + 4 CO
Calcula la masa de cromo que se obtendrá al hacer reaccionar 20 t de cronista del 80% de pureza. SOLUCIÓN: |
EJERCICIO 23. La descomposición de 5 g de KClO3 del 95% de pureza da lugar a la formación de KCl y O2. Si el rendimiento de la reacción es del 83%, calcula los gramos de KCl que se formarán.
SOLUCIÓN: |
REACTIVÓ LIMITANTE. En
la mayoría de las ocasiones, las sustancias que reaccionan no se
encuentran en la proporción exacta requerida por los coeficientes de
la ecuación. La reacción finaliza cuando el reactivo que está en
menor proporción, llamado reactivo
limitante,
se acaba, mientras que el exceso de los demás queda sin reaccionar,
son los reactivos
en exceso. Por tanto, el resctivo limitante es el que determina la cantidad maxima de producto.
EJEMPLO 7. Las cerillas utilizan como cabeza un sulfuro de fósforo que se prepara calentando una mezcla de azufre y fósforo 4 P + 3 S → P4S3. Si en un experimento de mezclaron 25 g de fósforo y 15 g de azufre. Calcula la masa de sulfuro de fósforo que podrá obtenerse.
SOLUCIÓN: |
EJERCICIO 24. En la reacción entre el ácido clorhídrico y el cadmio se producen hidrógeno y cloruro de cadmio. Si disponemos en un matraz 18g de HCl y 12g de Cd:
a)¿Cuánto cloruro de cadmio se formará si la reacción es total?
|
Un aspecto importante de las reacciones que convienen conocer y controlar es la velocidad con la que transcurren.
La velocidad de una reacción es la rapidez con la que desaparecen los reactivos o se forman los productos. Algunas reacciones químicas se producen de forma rápida y otras son lentas. Por ejemplo, las explosiones y detonaciones son tan rápidas que resulta muy difícil medir su velocidad. Una misma transformación puede ocurrir con distinta velocidad dependiendo de las condiciones.
La velocidad de una reacción es la rapidez con la que desaparecen los reactivos o se forman los productos. Algunas reacciones químicas se producen de forma rápida y otras son lentas. Por ejemplo, las explosiones y detonaciones son tan rápidas que resulta muy difícil medir su velocidad. Una misma transformación puede ocurrir con distinta velocidad dependiendo de las condiciones.
ACTIVIDAD 1. Teniendo en cuenta tu experiencia en el laboratorio o enla cocina y/o la teoría de las colisiones, emite hipótesis sobre qué factores influyen en la velocidad de reacción.
|
ACTIVIDAD 2. ⏩ Observa la simulación.
⏩ Video 1 ⏩ Video 2 ¿Cuáles son los dos principales factores que afectan a la velocidad de reacción? ¿Y cómo lo hacen? |
ACTIVIDAD 3. Explica como influye la superficie de contacto de los reactivos en la velocidad de las reacciones químicas.
|
6.1. LOS CATALIZADORES.
¿Sabes qué son los catalizadores? ¿Cómo actúan?
Los catalizadores son sustancias que aceleran una reacción química, proporcionando una ruta alternativa para romper y formar nuevos enlaces entre átomos. Su importancia reside en el hecho de que este nuevo camino requiere menos energía que el original, lo que facilita el proceso.
Imagine que hay un grupo de amigos que quiere ir del pueblo A al B, pero hay una montaña en medio. El grupo necesitaría mucha más energía para subir la montaña que si subiera a un tren que la rodeara. En este ejemplo el tren sería el catalizador que, sin consumirse, da vueltas y lleva a los amigos al pueblo B y vuelve todas las veces que hagan falta a recoger a los que todavía esperan en el pueblo de origen.
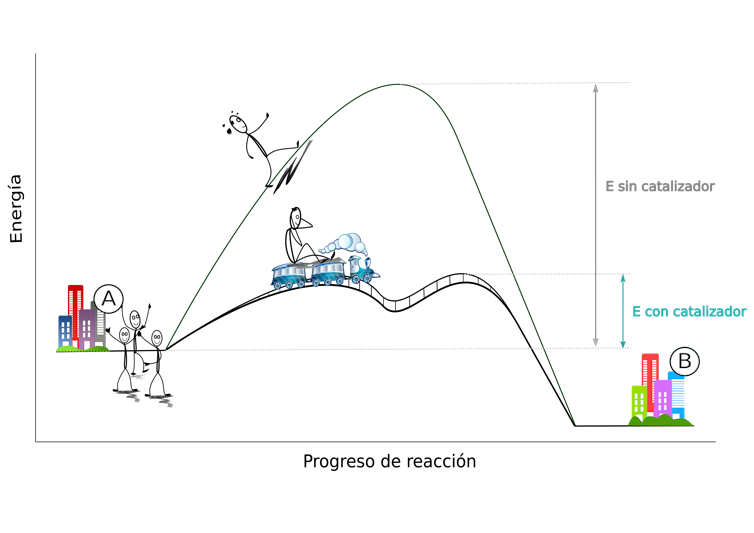
⏩ EJEMPLO 2
Los catalizadores son, normalmente, específicos para cada reacción. Por ejemplo, las enzimas son catalizadores naturales que tenemos en el cuerpo. Son responsables de catalizar casi todas las reacciones biológicas, y son necesarias para que estas ocurran lo suficientemente rápido y de forma selectiva.
Una muestra de 3.87 mg de ácido ascórbico (vitamina C) por combustión genera 5.80 mg de CO2 y 1.58 mg de H2O. ¿Cuál es la composición en porciento de este compuesto (el porcentaje de masa de cada elemento)?. El ácido ascórbico contiene solamente C, H y O.
CUESTIONES Y PROBLEMAS
P.1. Si comprimimos un gas en un recipiente cerrado, ¿cuál de las
siguientes afirmaciones es falsa?a) disminuye el volumen; b) aumenta la
temperatura; c) el número de moles permanece constante; d) disminuye la
densidad.
SOLUCIÓN:
SOLUCIÓN:
P.2. Cuántos átomos de oxígeno hay en 1 g de O2, O3 y de O?.
SOLUCIÓN:
P.3. Una muestra de un compuesto que pesa 83.5 g contiene 33.4 g de azufre. El resto es de oxígeno, ¿Cuál es la fórmula mínima?.
SOLUCIÓN:
P.4. ¿Cuántas moléculas de agua hay en 2 mL de una disolución de HCl , cuya densidad y % en masa son 1.19 g/mL y 37% en masa respectivamente?.
SOLUCIÓN:
P.5. Una muestra de 50 gramos de calcopirita contiene 28 gramos de CuFeS2. ¿Cuál es el porcentaje de cobre en la calcopirita?.
SOLUCIÓN.
SOLUCIÓN.
P.6. Se quiere preparar un volumen de 8 L de una disolución de KNO3 al 20% en masa y una densidad de 1.1326 g/mL a 20°C.
a) ¿Qué volumen de agua y qué masa de nitrato de potasio se debe mezclar?
b) ¿Cuál es la molaridad y cuál es la molalidad de la disolución preparada?
c) ¿Cuál es la fracción mol del soluto en esta disolución?
d) ¿En cuántos mL de la disolución hay 0.0025 moles de nitrato de potasio?
SOLUCIÓN.
P.7. Se tomaron 5 mL de H2SO4 cuya densidad es de 1.8 g/mL y 90% de pureza, y se aforaron hasta un volumen final de 500 mL, calcule la concentración de la disolución en % m/m, molaridad y normalidad.
P.7. Se tomaron 5 mL de H2SO4 cuya densidad es de 1.8 g/mL y 90% de pureza, y se aforaron hasta un volumen final de 500 mL, calcule la concentración de la disolución en % m/m, molaridad y normalidad.
SOLUCIÓN.
P.8. Se tiene una disolución A de HNO3 que tiene una densidad de 1.42 g/mL y una concentración en masa del 70%.
a) Calcula la molaridad de la disolución A.
b) De la disolución A se tomaron 5 mL y se llevaron a un volumen final de 500 mL. Calcula
la concentración de la nueva disolución.
c) Se requieren preparar 100 mL de una disolución 0.6 M a partir de la disolución A.
Calcule el volumen de disolución “A” que se debe utilizar para obtener la concentración deseada.
P.8. Se tiene una disolución A de HNO3 que tiene una densidad de 1.42 g/mL y una concentración en masa del 70%.
a) Calcula la molaridad de la disolución A.
b) De la disolución A se tomaron 5 mL y se llevaron a un volumen final de 500 mL. Calcula
la concentración de la nueva disolución.
c) Se requieren preparar 100 mL de una disolución 0.6 M a partir de la disolución A.
Calcule el volumen de disolución “A” que se debe utilizar para obtener la concentración deseada.
SOLUCIÓN.
P.9. Calcula la nueva molaridad al mezclar 150 ml de una disolución de HNO2 0,2 M con:
a) 100 ml de agua destilada.
b) 100 ml de una disolución de HNO2 0,5 M.
SOLUCIÓN.
P.9. Calcula la nueva molaridad al mezclar 150 ml de una disolución de HNO2 0,2 M con:
a) 100 ml de agua destilada.
b) 100 ml de una disolución de HNO2 0,5 M.
SOLUCIÓN.
P.10. La combustión del butano, C4 H10 , tiene lugar según la reacción:
C4 H10 (g) + O2 (g) ⇒ CO2 (g) + H2 O (g)
a)¿Cuántos gramos de oxígeno son necesarios para quemar 11,62 g de
butano?
b)¿Cuántos moles de CO2 y H2 O se producen en la combustión de
11,6 g de C4 H10 ?
P.11. Se tratan 3,18g de Cu con HNO 3 diluido según la reacción:
Cu(s) +HNO3 (aq) ⇒ Cu(NO3 )2 (s)+ NO(g) + H2 O(l)
a)¿Cuántos gramos de Cu(NO3)2 se producen?
b)¿Cuántos gramos de NO se producen?
P.12.-¿Qué masa de cloruro de plomo (II) se puede obtener a partir de
una mezcla de reacción que contiene 20 g de cloruro de plomo(IV) y 45 g de
fluoruro de plomo (II)?
PbF2
+ PbCl4 ⇒ PbF4 + PbCl2
P.13. El ácido nítrico reacciona con Zn desprendiéndose hidrógeno en el
proceso:
HNO 3 + Zn ⇒ Zn(NO3)2 + H 2
a)¿Cuántos moles de H 2 se desprenderán a partir de 200 g del metal?
b)¿Qué volumen ocupa el gas desprendido a 1 atm y 28º C?
P.14. El MgCO3 reacciona con HCl para dar MgCl2, CO2 y H2O, Calcula el volumen de una disolución de HCl del 32% en peso y 1,16 g/mL de densidad que se necesitará para que reaccione con 30,4 g de MgCO3 .
P.15. HABÍA UN ERROR. (si ya estaba hecho, los dejáis) La aspirina (ácido acetil salicílico) se prepara por calentamiento del ácido salicílico (C7H6O3) con el anhídrido acético (C4H6O3). C7H6O3 + C4H6O3 ⇒ C9H8O4 + C2H4O2 . Cuando se calientan 2.0 g de ácido salicílico con 4.0 g de anhídrido acético
a) ¿Cuántos g de de aspirina se forman, C9H8O4?
b) ¿Cuál es el % de rendimiento, si experimentalmente se obtuvieron 2,1 g?
P.16. Hacemos reaccionar trioxocarbonato (IV) de calcio con cloruro de hidrógeno formándose dicloruro de calcio, dióxido de carbono y agua
Si reaccionan 30,0 g de trioxocarbonato (IV) de calcio con 30,0 g de cloruro de hidrógeno, calcular:
a) Qué masa de dicloruro de calcio se forma.
b) Qué masa de dióxido de carbono se forma.
c) Qué volumen ocuparía ese dióxido de carbono en condiciones normales.
Si reaccionan 30,0 g de trioxocarbonato (IV) de calcio con 30,0 g de cloruro de hidrógeno, calcular:
a) Qué masa de dicloruro de calcio se forma.
b) Qué masa de dióxido de carbono se forma.
c) Qué volumen ocuparía ese dióxido de carbono en condiciones normales.
P.17. El cloruro de aluminio, AlCl3, se utiliza como catalizador en diversas reacciones industriales. y se prepara a partir del cloruro de hidrógeno gaseoso y viruta de aluminio metálico. Considerando que un vaso de reacción contiene 0.15 mol de Al y 0.35 mol de HCl.
2 Al(s) + 6 HCl(g) → 2 AlCl3(s) + 3 H2(g)
Clacule cuántos moles de AlCl3 se pueden preparar a partir de esta mezcla?
P.18. Para la reacción: NaCl + AgNO3 → AgCl + NaNO3
a) Determina la masa de AgCl obtenida a partir de 100 ml de disolución de AgNO3 0,5 M y 100 ml de disolución de NaCl 0,4 M según la reacción.
b) Calcula los moles del reactivo que quedan en exceso (sin reaccionar).
P.19. Una mezcla de 10 g de hidrógeno y 10 g de oxígeno da lugar a agua. Responde a las siguientes preguntas:
a) Ajusta la reacción química.
b) ¿Cuál es el reactivo limitante de la reacción?
c) ¿Cuánta cantidad sobra del reactivo en exceso? d) ¿Cuántos gramos de agua se forman?
SOLUCIÓN.
a) Ajusta la reacción química.
b) ¿Cuál es el reactivo limitante de la reacción?
c) ¿Cuánta cantidad sobra del reactivo en exceso? d) ¿Cuántos gramos de agua se forman?
SOLUCIÓN.
P.20. Para determinar la riqueza de una partida de cinc se tomaron 50 g de muestra y se trataron con ácido clorhídrico del 37 % en peso y 1,18 g/mL de densidad, consumiéndose 126 mL de ácido. La reacción de cinc con ácido produce hidrógeno molecular y cloruro de cinc. Calcula el porcentaje de cinc en la muestra.
SOLUCIÓN.
P.22. El hierro puede obtenerse según la reacción: Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
El análisis de una muestra de 978 g de un mineral que contiene óxido férrico ha dado 354 g de hierro. ¿Cuál es la riqueza en óxido de hierro (III) del mineral?
P.22. El hierro puede obtenerse según la reacción: Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
El análisis de una muestra de 978 g de un mineral que contiene óxido férrico ha dado 354 g de hierro. ¿Cuál es la riqueza en óxido de hierro (III) del mineral?
P.23. La descomposición térmica del clorato de sodio produce cloruro de sodio y oxígeno. Calcula el rendimiento de la reacción si a partir de 100 g de clorato sódico se han obtenido 43,2 g de oxígeno.















